전기분해 와 전지
페이지 정보
작성자 관리자 댓글 0건 조회 8,811회 작성일 14-06-05 16:18본문
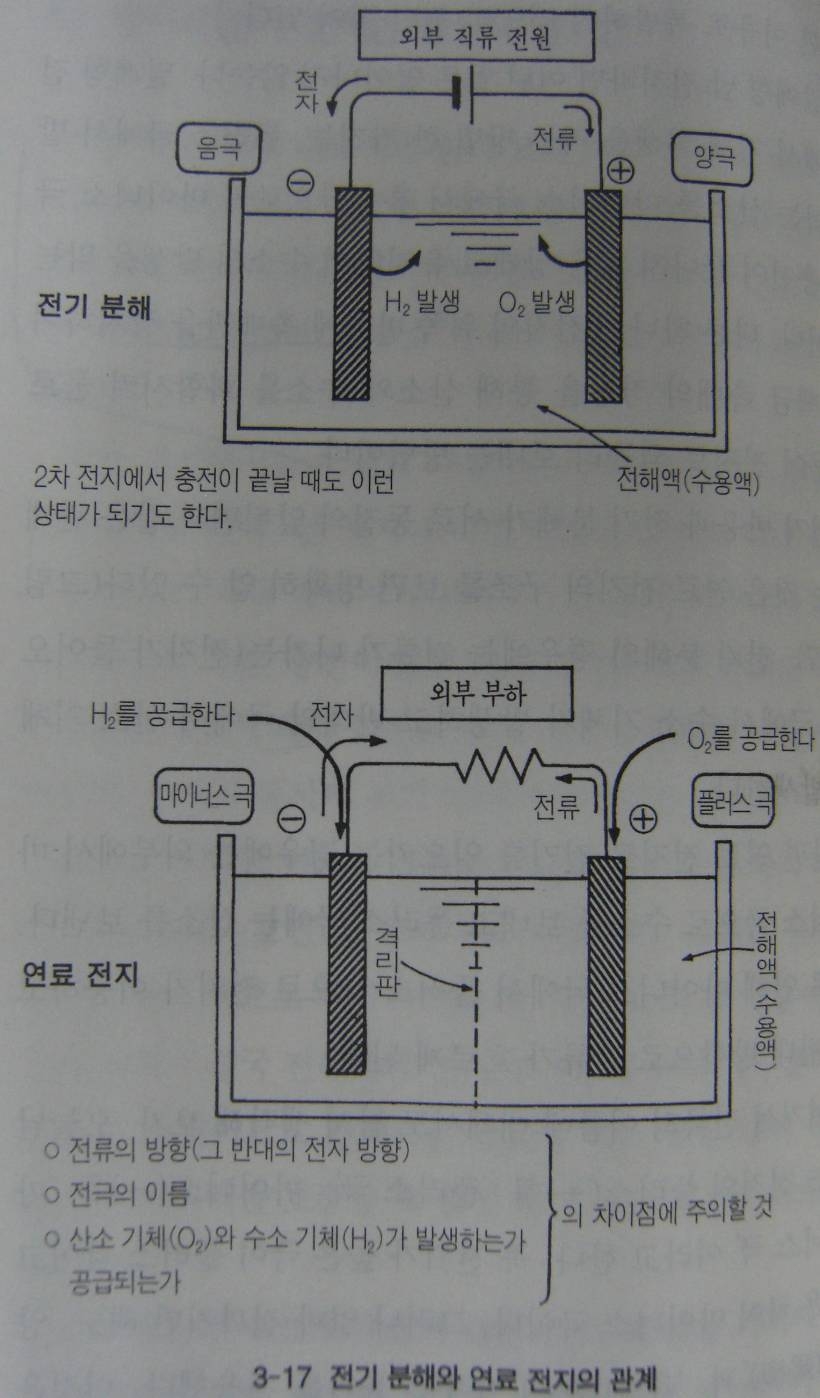
화학반응식을 읽다 보면, 전지반응은 물의 전기분해와 반대라는 것을 알게 된다. 물에 2개의 전극을 꽂고 외부에서 전압을 걸어주면 플러스 극에서는 산소기체가 마이너스 극에서는 수소기체가 나온다. 이것이 전기 분해 이다.
전지에서도 어떻게 사용하는가에 따라 전기분해가 일어나기도 한다. 납전지나 니켈 카드뮴전지 경우 충전중에 전기가 채워지기 전까지는 조용히 외부에서 에너지가 보급되지만 충전이 끝날 때가 가까워지면 플러스극과 마이너스 극에서 각각 산소와 수소기체가 활발히 나오기 시작한다. 충전과 동시에 전기분해가 일어나는 것이다.
황산속의 황산이온은 전해액과 전극 사이를 오가기 때문에 전지 전체로 보면 그 양이 변하지 않는다. 그러나 산소와 수소는 전지 밖으로 나가기 때문에 황산속의 물성분이 점차 감소하여 결국 전해액의 양이 줄어들게 된다. 단 줄어드는 것은 물뿐이므로 전해액을 보충할 때도 물만 넣어주면 된다. 배터리액을 보충할때 물만 넣어주는 이유가 바로 이 때문이다.
전지반응과 전기분해가 서로동전의 앞뒷면과 같은 관계라는 것은 연료전지의 구조를 보면 명확히 알 수 있다. 전기분해의 경우에는 전류가 나가는 (전자가 들어오는) 극에서 수소기체가 발생하고 반대의 극에서 산소기체가 발생한다.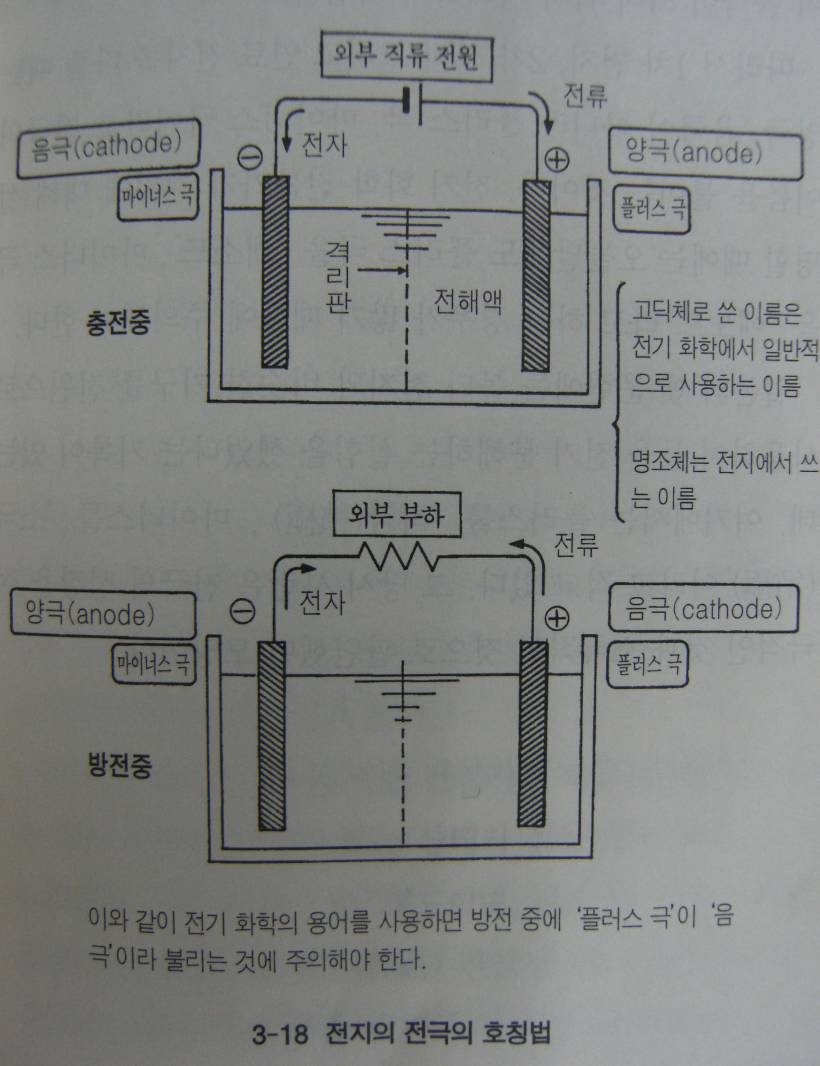
한편 연료 전지로 전기를 일으키는 경우에는 외부에서 마이너스 극으로 수소를 보내고 플러스 극으로 산소를 보낸다. 이로 인해 마이너스 극에서 플러스 극으로 전자가 이동하고 그 반대방향으로 전류가 흐르게 된다,
여기서 전극의 이름에 대해서도 생각해보면 오늘날 전지의 “+”를 플러스 극 “–“를 마이너스 극이라고 한다, 즉 전위가 높은 극이 플러스 극이고 낮은 극이 마이너스 극이다. 그러나 이전에는 양극과 음극이란 용어를 사용했다. 이것은 전기화학에서는 전기분해 장치를 기술할 때 전위의 높고 낮음이 아니라 전자의 이동을 기준으로 삼고 있기 때문이다. 전자가 외부의 전선을 통해 나가는 전극을 양극 (anode) 들어오는 전극을 음극 (cathode)이라고 한다.
그런데 전지에서 이 명칭을 사용하면 혼동의 소지가 있다, 그림과 같이 2차전지인 납전지 경우 충전중에는 플러스 극이 양극이기 때문에 별 문제가 없지만 방전 중에는 플러스 극이 음극이 되어버리기 때문에 혼란스럽다. 건전지와 같은 것은 방전만 하기 때문에 항상 플러스 극이 음극이 되어 역시 이해하기 어렵다.
댓글목록
등록된 댓글이 없습니다.


