레독스플로우형 전지
페이지 정보
작성자 관리자 댓글 0건 조회 6,955회 작성일 15-02-06 19:09본문
레독스플로우 란 redox(reduction,환원)과 oxidation(산화) 의 합성어로 산화,환원이란 뜻이다. 따라서 일반적인 전지도 세부적인 차이를 떠나서 기본적으로는 모두 레독스형 전지라고 할 수 있다.
문제는 플로우 flow 곧 흐름이라는 단어가 붙어있다. 즉 레독스플로우 전지에는 흐름이 있다. 그것도 산화와 환원이라는 정반대의 역할의 유체가 충전과 방전시에 연속해서 흘러 막을 사이에 두고 서로 반응하는 것이다. 이렇게 양쪽 활물질이 흐른다는 것은 전지로선 돌연변이라고 할 수 있는 독특한 구조이다.
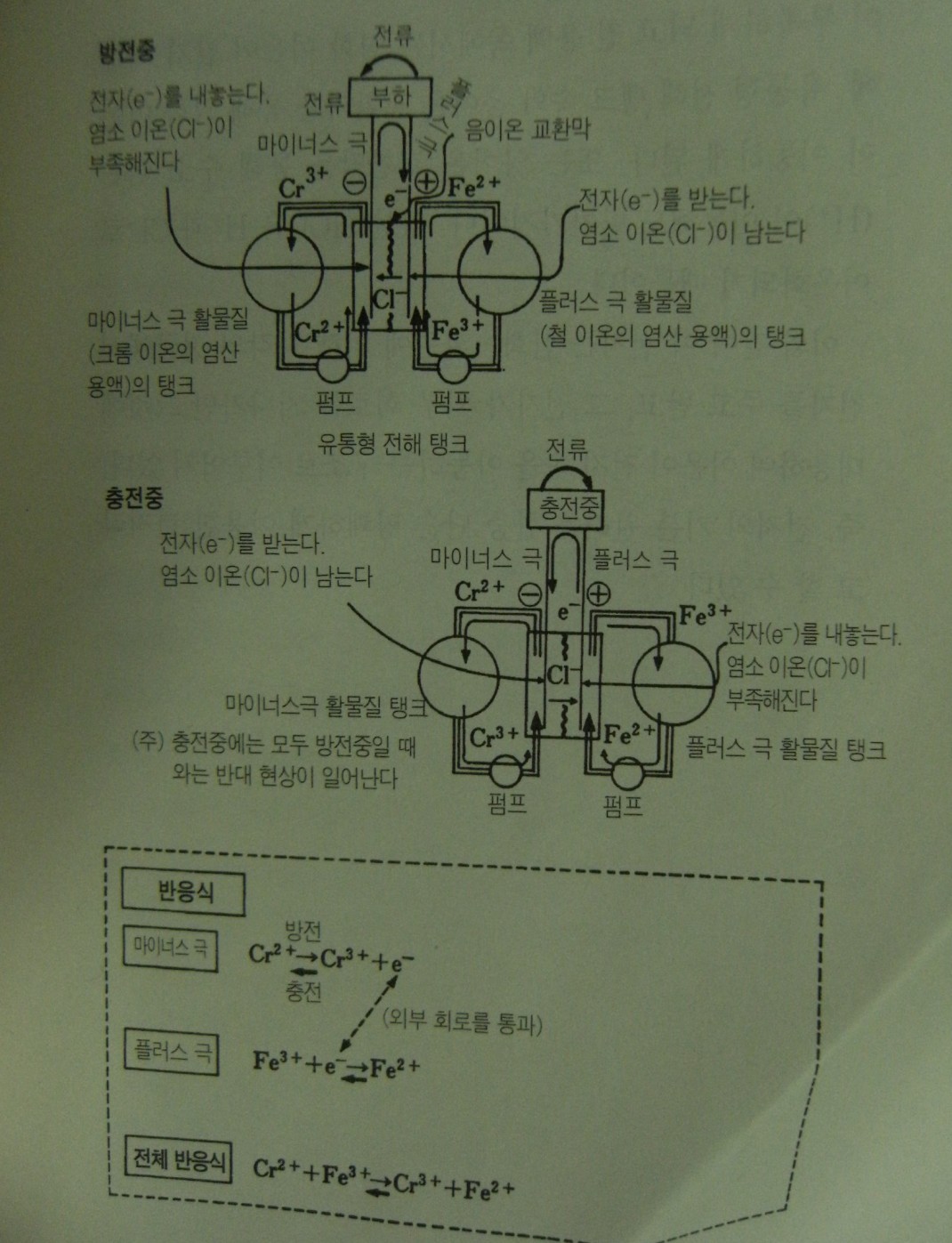
레독스플로우형 전지의 얼개가 그림에 나와있다. 하나의 전지안에서 이온교환막을 사이에두고 철이온이 녹아있는 염산(전해액)과 크롬이온이 녹아있는 염산(전해액)을 각각의 탱크에서 펌프를 통해 흘려보내면 이온교환막을 통하여 염화이온 Cl-이나 수소이온 H- 이 이동함으로써 충전과 방전이 일어난다. 마치 신장용 인공투석 장치나 조그만 화학공장 설비를 연상시키는 구조이다,
방전시 플러스극 활물질인 철이온은 3가 (Fe3+) 에서 2가 (Fe2+) 로 환원(전지를 얻는 것)되고 마이너스 극활물질인 크롬이온은 2가(Cr 2+) 에서 3가(Cr3+)로 산화(전자를 잃는 것)된다. 충전시에는 이와 반대로 반응이 진행된다.
여기에서 양쪽 끝의 활물질이 모두 양이온이라는 점에 주목할 만하다. 같은 양이온이라도 2가와 3가라는 차이가 있으며 전지의 교환, 즉 산화와 환원이 일어나기 때문에 전지반응은 확실히 일어난다.
이 전지의 원리는 예전부터 알려져 있었지만 두전해액을 갈라놓는 방법이 문제였다. 또한 레독스플로우형 전지에는 탱크용량을 바꾸는 것만으로 전지용량이 바뀌는 재미있는 성질이있다,
주의해야할 것은 레독스플로우형 전지는 산화.환원에 따라 전자를 주고받는 반응이 각각의 전지에서 따로따로 일어난다는 점이다. 외부의 탱크에 양쪽 활물질을 비축해 두었다가 연속적으로 공급해준다는 점에서 2차전지라기 보다는 오히려 “재생가능한 연료전지”라고 할 수 있다.
그림에 서 알수있듯이 방전할 때 왼쪽탱크에서는 2가의 크롬이온 (Cr 2+) 이 펌프를 통해 중앙의 유통형 전해 탱크(전지본체) 의 마이너스 극 (탄소섬유) 으로 보내진 후 전자를(e-) 방출하여 3가의 크롬이온(Cr3+) 으로 산화되어 원래의 탱크로 돌아온다. 오른쪽 탱크에서는 반대로 3가의 철이온((Fe3+) 이 전자를 받아들여 2가의 철이온(Fe2+) 으로 환원된다. 이 반응에 의해 크롬용액 쪽에서는 염화이온 (Cl-) 이 부족하게 되고 철 용액쪽에서는 염화이온이 남기 때문에 유통형 전해탱크 속의 음이온 교환막을 통해 염화이온이 이동하게 된다. 또는 양이온 교환막을 통해 수소이온이 이동해도 마찬가지 이다.염산은 (HCl) 은 H+과 Cl-로 이온화되기 때문이다.
이와 같이 이 전지는 산화.환원의 의해 각각의 전극에서 전자를 주고받고 그 전자가 외부회로를 지나가면 그것에 대응하여 이온이 전지속을 이동하는 구조로 이루어져있다,.
즉 전지의 기본원리를 한층 단순 명쾌하게 이용한 전지라 할 수 있다.
댓글목록
등록된 댓글이 없습니다.


