연료전지
페이지 정보
작성자 관리자 댓글 0건 조회 6,063회 작성일 15-03-27 17:56본문
연료전지는 건전지(1차 전지), 축전지(2차 전지) 의 뒤를 잇는 ‘세번째 화학전지”로 주목을 받고 있다. 마이너스 극으로 수소를 공급하여 연료로 삼고 플러스 극으로 산화제인 산소를 공급하여 전해질 속에서 반응시켜 전지를 만들어낸다,
일반적인 망간 건전지에서 아연을 수소로 이산화망간을 산소로 각각 바꿔 넣은 것이라고 생각할 수 도 있다. 수소와 산소는 전지 안으로 들어가면 곧장 반응을 일으켜 전기를 만들어내는데, 나중에 반응하도록 모아 두는 것이 불가능하므로 전지라고는 해도 태양전지와 마찬가지로 에너지를 저장할 수 없는 전지이다,.
연료라는 말이 이름에 들어가 있지만 연료전지 안에서 빛과 열을 내면서 활활 타는 연소반응이 일어나는 것은 아니다. 또 연소반응에서는 수소와 산소가 한곳에서 만나 화합하지만 연료전지에서는 산소와 수소가 각각 플러스극과 마이너스 극에서 따로따로 반응한다. 단 보통전지와 달리 반응온도가 상당히 높은 것은 사실이다,
전기를 만들면서 동시에 물이 생긴다는 편리함이 장점이며 미국의 아폴로 위성이나 우주왕복선 등에 사용되고 있다,.물에 전류를 흘려 보내 수소와 산소를 만드는 것, 즉 전기분해를 떠올리는 사람들도 있을 텐데, 실제로 연료전지의 개발은 이 전기분해에서 힌트를 얻었다고 한다, 연료전지는 공기전지에서 아연대신 수소를 사용한 것이라고 생각 할수도 있다,그러나 실제 연료전지는 공기전지의 단추모양과는 닮은 구석이 전혀 없다, 이름은 같은 “전지”이지만 연료전지는 어엿한 화학 공장의 모습을 하고 있다.
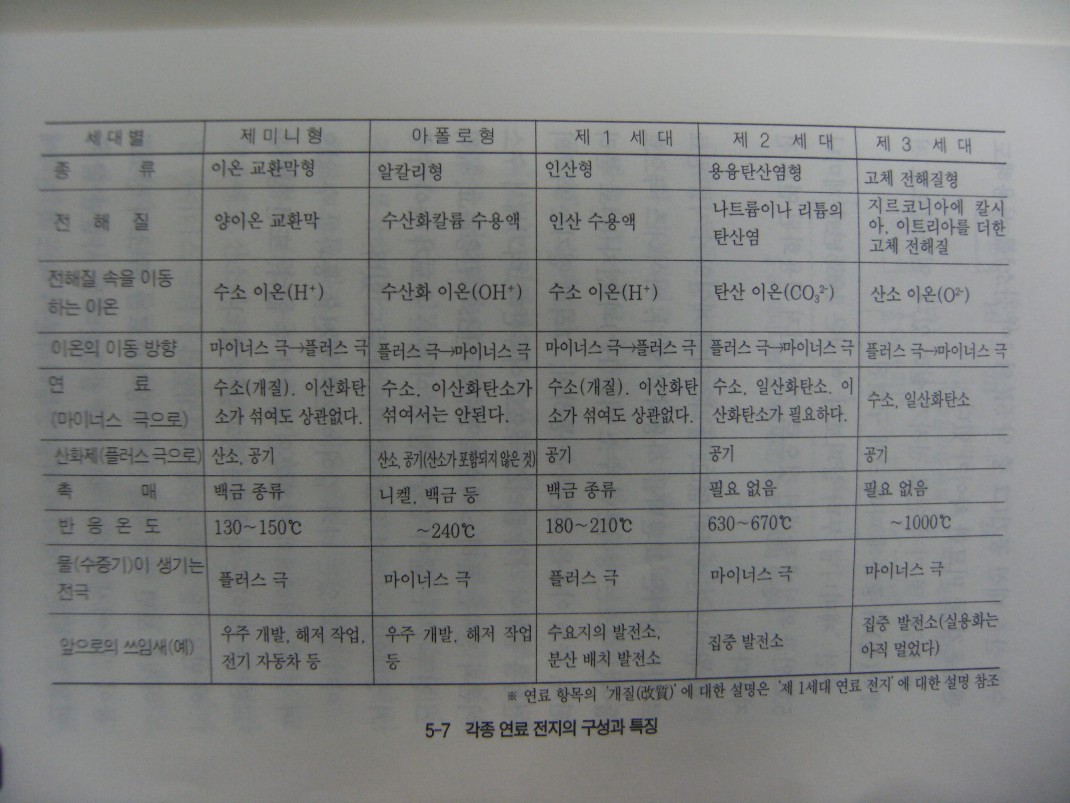
연료전지는 몇 종류로 나눌 수 있는데, 화학전지의 4요소인 +,- 활물질,전해질, 격리판 이외에 촉매라든가 가스를 보내는 전극의 재료 및 구조 등 검토해야 할 사항이 많다,
‘보내는 기체가 산소와 수소 두 가지로 결정되어 있으니 어렵게 생각할 것이 없지 않을까? 라고 말할 수도 있지만 실제로는 그렇게 간단하지가 않다, 수소에 이산화탄소가 포함되어 있어도 괜찮은가? 불순물은 어떤가? 또한 순수한 산소대신 공기 (1/5 산소인)를 사용해도 괜찮은가 등 미묘한 차이가 있다.
표에 몇 가지 연료전지가 실려있다. 일반적으로 전해질에 따라 크게 구분한다.
댓글목록
등록된 댓글이 없습니다.


