리튬전지
페이지 정보
작성자 관리자 댓글 0건 조회 8,068회 작성일 14-01-10 17:43본문
리튬 1차 전지는 처음에는 군용으로 개발되었는데 민간 목적으로는 일본에서 최초로 실용화된 전지이다. 이 전지는 마이너스 극에 얇은 금속 리튬박을 사용하고, 플러스 극에는 이산화망간과 플루오르화흑연(모두 공칭 전압은 3V) 산화은 (3V) 산화구리 (1.55V) 염화티오닐 (3.6V) 등을 사용한다.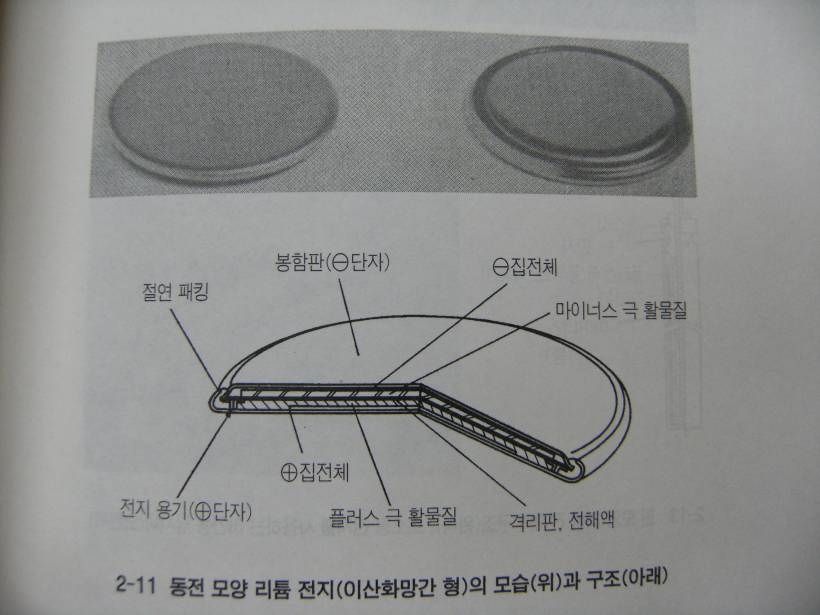
버튼 전지보다 더 얇게 동전모양으로 만들어진 것이 많지만 이외에도 원통모양, 0.5mm두께의 종이모양, 낚시하는데 사용하는 핀 모양 등 여러 가지 형태로 개발되고 있다.
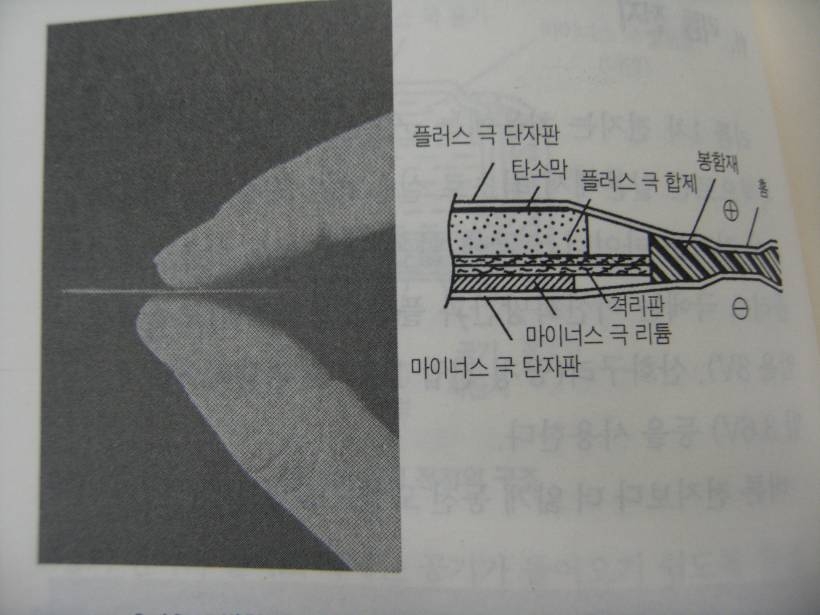
리튬은 주기율표에서 수소와 헬륨 다음으로 등장하는 원소로 물보다 가벼운 금속이다, 물과 반응하는 성질이 있으므로 다른 전지들과는 달리 수용액이 아닌 유기용매를 전해액으로 사용한다.
리튬전지는 매우 얇게 만들 수 있다는 장점을 가지고 있다. 전지를 얇게 만들면 전해액으로 유기용매를 사용했을 때 내부저항이 높아지는 결점도 보완할 수 있다. 또한 자기방전도 적다. 이러한 장점 덕분에 10년이나 연속 사용할 수 있는 리튬전지도 개발되었다.
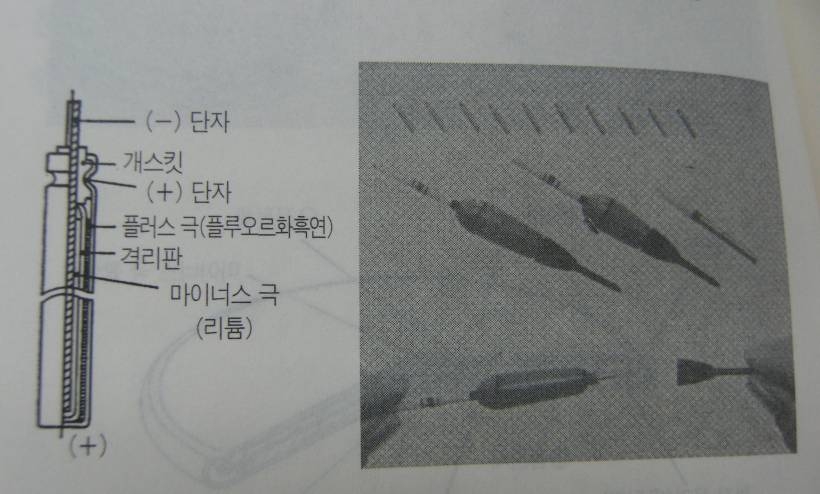
3V 짜리 리튬전지는 1개로 1.5V 전지 2개를 대신 할 수 있다는 장점이 있다, 한편 최근에는 계산기와 시계에 쓰이는 LSI가 종래의 절반인 1.5V전압이면 작동할 수 있게 되어있어 플러스극에 산화구리를 사용한 1.55V짜리 리튬전지도 등장했다,
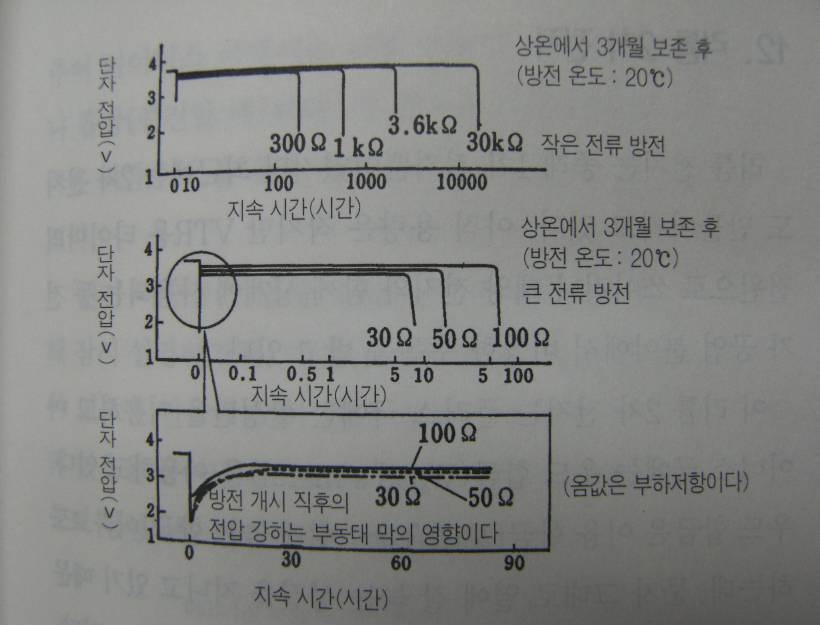
3.6V형 리튬전지는 염화티오닐을 플러스 극 활물질 겸 전해액으로 사용하고 있다, 일본의 도시바 전지가 벌표한 ER6라는 리튬전지는 AA크기로 7Wh의 전력량을 지니고 있는데 이것은 종래의 같은 크기의 이산화망간 리튬전지에 비해 전력량이 2배나 되는 것이다, ER6는 방전특성이 좋고 사용할 수 있는 온도범위도 넓어졌다. (-55~85도)
플러스 극 활물질 겸 전해액으로 사용되는 염화티오닐 (SOCl2)은 무색의 액체로 물에 닿으면 아래와 같은 반응을 통해 염화수소 (HCl)와 이산화황(SO2)으로 분해된다,
SOCl2+H20--à2HCl+SO2
따라서 염화티오닐 리튬전지는 확실하게 밀폐된 구조로 만들어야 하며 고온에서 사용하는 것도 위험하다. 액이 새는 것을 방지하기 위해 전지를 만들 때 특히 안전에 주의를 기울어야 한다,
댓글목록
등록된 댓글이 없습니다.


