전지반응식
페이지 정보
작성자 관리자 댓글 0건 조회 6,722회 작성일 14-05-28 14:54본문
전자의 이론을 알고자 하는 이유로 화학반응구조를 소개하도록 하겠다,
전자의 기본적인 구성은 플러스극은 산화제 마이너스 극은 환원제이다. 여기서 산화란 상대에게 산소를 주는 것이고 (또는 상대로부터 전자를 받아들이는 것이고) 환원은 상대로부터 산소를 빼앗는 것 (또는 상대에게 전자를 주는 것)이다. 따라서 산화와 환원은 동전의 앞,뒷면과 같은 관계이며 대표적인 반응이다.
우선 반응식에는 주 종류가 있다, 플러스극, 마이너스 극 각각에서 일어나는 반응을 표시하는 개별적인 반응식이 있고 이 개별반응을 모아 놓은 전체 반응식이 있다.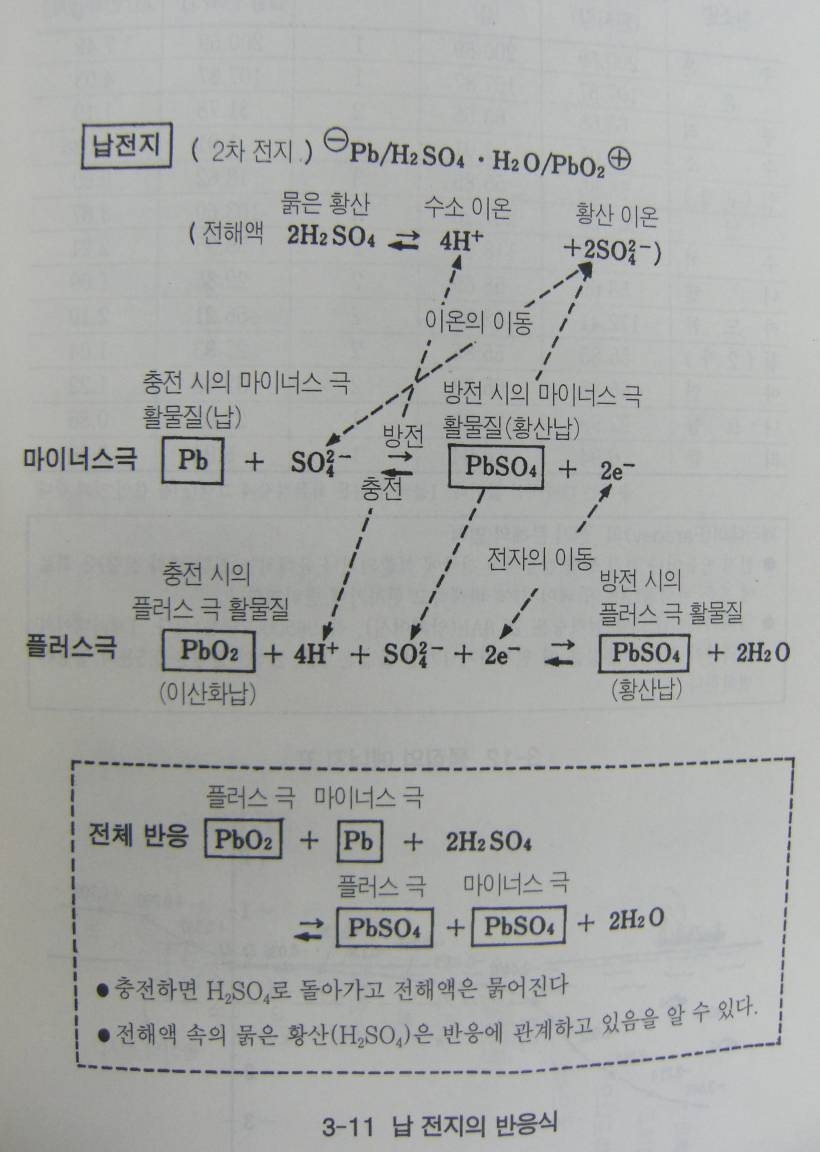
전체반응식은 전지 전체의 반응을 아는데는 좋지만 각각의 전극에서 일어나는 반응은 알 수 없다, 전자의 교환 발생하는 에너지의 양, 어는 전극에서 산화에 물이 생겨나는가 하는 등의 사항들을 전혀 알 수 없다. 개별 반응식에는 이러한 사항들이 잘 나타나 있다.
그림에서 반응식에 표시되어 있는 “방전” “충전” 이라는 화살표에 주의하자 반응식은 왼쪽에서 오른쪽으로 이동하면 방전이고 그 반대가 충전이다,
전체 반응식을 작성하는 방법은 보통 수학식과 마찬가지로 ‘좌변과 우변을 더하여 소거할 수 있는 것은 소거하기만 하면 된다.
예를 들어 납전지를 방전하면 황산의 밀도가 내려간다. 이는 황산납이 양쪽 전극에서 만들어지면서 황산이온 SO4 2-
이 소비되고 동시에 플러스 극에서 물이 생기기 때문이다. 전체 반응식에서는 이러한 사실을 알 수 없다. 기껏해야 황산납과 물이 생성되는 것을 알 수 있을 뿐이다.
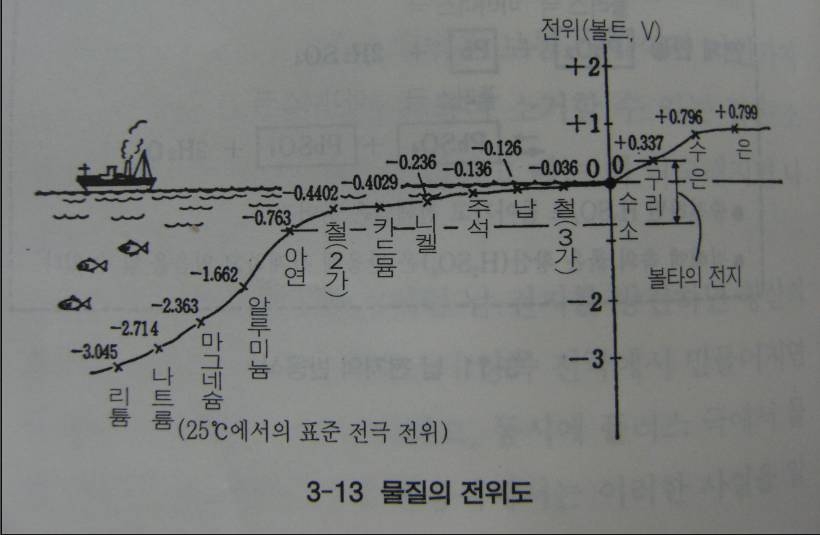
전지 반응식을 살펴보면 전지반응을 통해 생겨나고 흡수되는 에너지의 양과 발생전압도 알 수 있다, 이것을 판독하기 위해선 에너지 표와 전위도가 필요하다.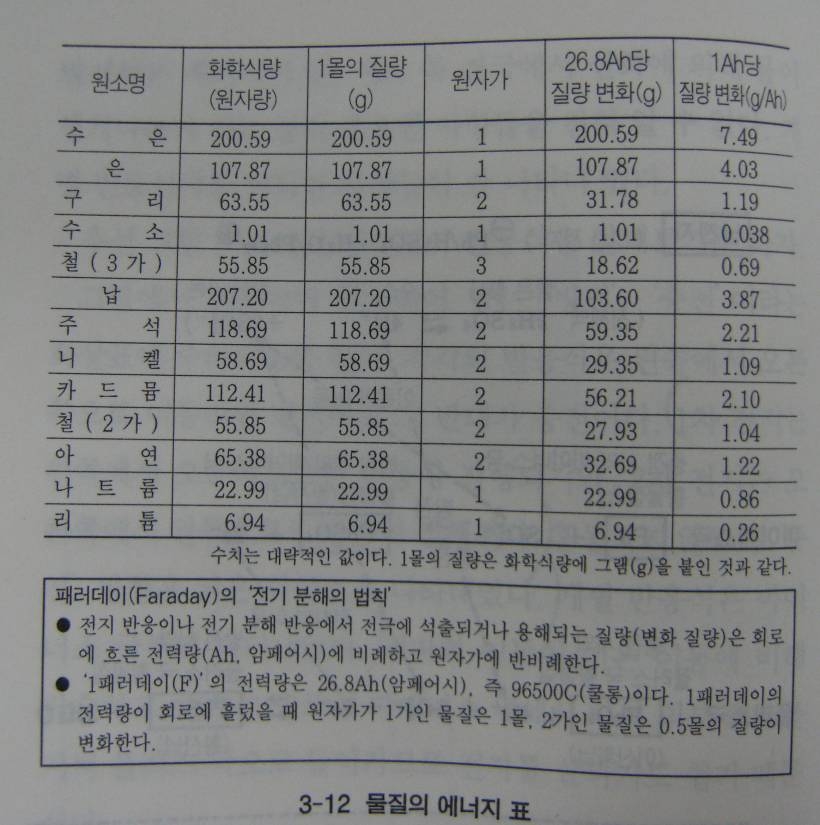
전위도란 전위의 지도라고 생각하면 된다. 지도에서 보면 해면을 기준으로 산과 바다의 높낮이를 플러스와 마이너스롤 나타내듯이 전위를 표시한 것이다. 예컨대 볼타 전지에서 플러스 극의 전위는 +0.34V이고 마이너스 극의 전위는 -0.76V이다 이 절대값을 합하면 1.1V가 되는데 이것은 두 전극 사이의 전위차 곧 볼타전지의 기전력이 된다.
댓글목록
등록된 댓글이 없습니다.


